概要
脳の速い情報処理は電気的な信号によって行われています。中でも大脳皮質や海馬の主要な興奮性神経である錐体細胞には、信号の入力と出力部位があります。 樹状突起上の複数のスパインと呼ばれる後シナプスで興奮性シナプス後電位(EPSPs)として情報入力を受け、その統合された振幅が軸索小丘で閾値を超えたときに軸索から活動電位として出力されます。しかし、スパインはあまりに小さすぎるために直接膜電位を測ることができず、未だに何mVの入力が個々のスパインで発生しているのかすら、正確にはわかっていません。そこで電気生理的な手法と光学測定法を組み合わせて、より正確にシナプス入力を測定し、神経内部のの非線形的な計算機能を解明する研究を行っています。これにより、入出力の関係を解明することだけでなく、入力経路のよる詳細な違いや、可塑性によるシナプス入力の変化を単一シナプスのレベルで解明することができると期待しています。
単一スパインからの光学測定
この20年で光学測定法の発達により、単一スパインからカルシウムイオンや膜電位の変化を計測することが可能となってきました。しかし、脱分極を発生させる為の主なイオンであるナトリウムイオンの光学測定は行われていませんでした。以前ニューヨーク医科大学のRoss博士とともに(1)海馬のCA1錐体細胞の単一シナプスからのナトリウムイオンの計測と、(2)より正確な時間経過を測定できる低感受性カルシウム色素を用いたカルシウムイメージングを同時に計測する方法を開発し、いくつかの単一スパインでの入力に関する知見を得てきました。
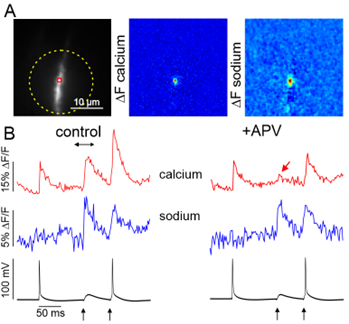
(1)単一スパインでの光学測定:ナトリウムイメージング
ナトリウムイオンは興奮性シナプス後電位(EPSP)を発生させる主要なイオンであるにもかかわらず、単一スパインでの測定はされていませんでした。これは、ナトリウムイオンはカルシウムイオンと異なり変化量が2-3倍程度しかなく、その変化を検出するのが難しいことによります。(変化量は少ないですが、カルシウムイオンと比べて、流入量はとても多いので電位変化の主要なイオンとなります。)しかし、2017年に初めてシナプス刺激による単一シナプスでのナトリウムイオンの測定に成功しました。(Miyazaki and Ross, 2017)
(2)単一スパインでの光学測定:低親和性カルシウム色素によるカルシウムイメージング
カルシウムイメージングは現在の神経科学において主要な方法になっています。特にGCaMP6などの蛋白質を利用したカルシウムイメージングは特定の神経細胞からのみ信号を得ることができ、神経科学の発展に大きく貢献しています。しかし、一方でこれらのカルシウム感受性蛋白やOGB-1やFluo-4などに代表される高親和性カルシウム指示薬は、その結合力の高さゆえに本来のCa2+の応答時間や振幅を大きく歪めてしまいます。そこで今まで単一スパインの研究には使われていなかった、低親和性カルシウム色素での記録法を開発しました。これにより、正確なカルシウムイオンの流入変化や、時間経過を測定できるようになりました。(Miyazaki and Ross, 2022)
結果
これらの手法を使い、シナプス刺激によるEPSPは主にAMPA型グルタミン酸受容体から流入するナトリウムイオンによるものであり、そのイオンは瞬時に樹状突起への拡散することを示しました(spine neck resistance = 92 - 250MΩ)。さらにカルシウムイオンは主にNMDA型グルタミン酸受容体から流入することを示しました。この発見によりAMPA型グルタミン酸受容体は主に電気的なシナプス伝達を担っており、NMDA型グルタミン酸受容体は主にカルシウムイオンを介した細胞内シグナル伝達を担っているものと考えられます。
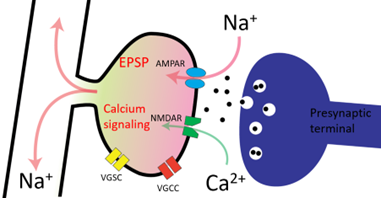
これらの手法は今後、膜電位依存性があるためシナプス同士で振幅を比較するのが難しいカルシウムイメージングや、広域に広がる膜電位のために他のシナプスからの影響を受けやすい膜電位イメージングと異なり、シナプス入力の大きさをを独立的に計測できる可能性があり、今後入力経路によるシナプスの違いや可塑性によるシナプス入力の変化を明らかにできるものと考えています。